Una vacuna desarrollada por la biotecnológica Moderna con los Institutos Nacionales de Salud de Estados Unidos (NIH) generó una “robusta” respuesta inmunitaria al frenar la replicación del nuevo coronavirus en los pulmones y nariz de monos, según resultados divulgados el martes.
Esta es una de las dos vacunas occidentales, junto a la elaborada por la Universidad de Oxford con la farmacéutica australiana AstraZeneca, que comenzó a ser experimentada a gran escala.
Por su parte, Estados Unidos invirtió casi US$1.000 millones para apoyar las investigaciones, aunque la misma nación le pagó casi el doble a los laboratorios Pfizer y Biontech a modo de asegurar 100 millones de dosis.
Siete de ocho monos vacunados en este estudio, y expuestos cuatro semanas después al nuevo coronavirus, no habían registrado una replicación detectable del patógeno en sus pulmones dos días después, y ninguno tenía virus en la nariz según los resultados publicados en el New England Journal of Medicine.
Científicos constataron que la administración en dos dosis con 28 días de diferencia no solo generó anticuerpos contra el coronavirus, sino que también produjo linfocitos T, que son indispensables para la respuesta inmunitaria.
“Es la primera vez que una vacuna experimental contra la covid-19 probada en primates muestra su capacidad de producir un rápido control viral en las vías respiratorias superiores”, dijo el NIH en un comunicado.
Los científicos notaron que la vacuna que desarrolla Oxford no logró efectos en la cantidad de virus en la nariz de los monos.
Reducir los virus en los pulmones tornaría menos agresiva la enfermedad mientras que la disminución de los que están en la nariz reduciría el potencial contagio de quienes rodean a la persona infectada.
Pero solo los ensayos en humanos, que están en curso, permitirán verificar si una u otra vacuna protege a las personas.
Para la vacuna de Oxford/AstraZeneca, los resultados podrían conocerse a partir de septiembre y desde octubre en el caso de la vacuna de Moderna.
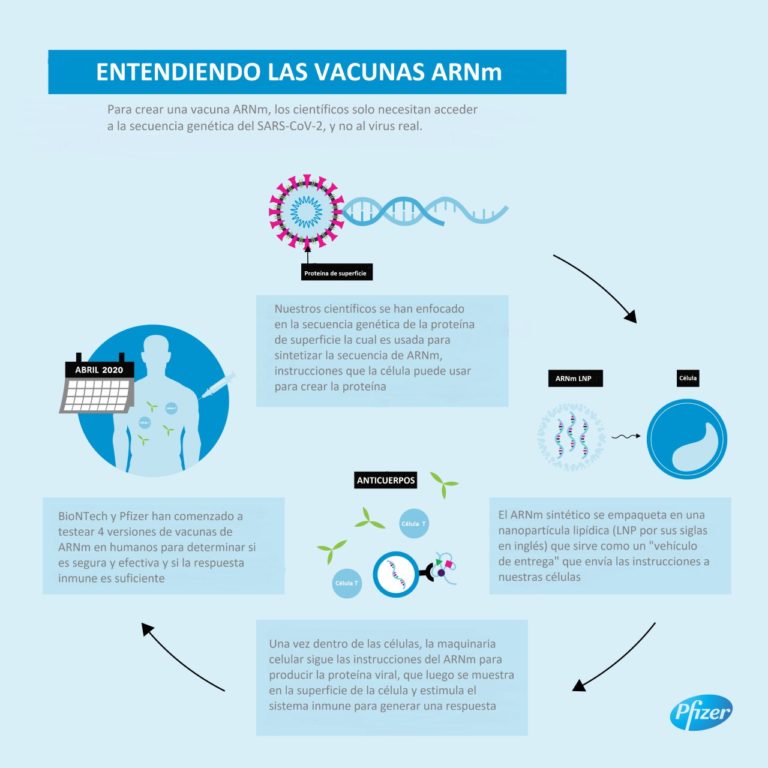
Pfizer y BioNTech eligen candidata principal a la vacuna ARNm contra Covid-19
Después de una extensa revisión de los datos preclínicos y clínicos de los ensayos de Fase 1/2, y en colaboración con el Centro de Evaluación e Investigación Biológica (CBER) de la FDA, entre otros reguladores mundiales, Pfizer y BioNTech han optado por avanzar su candidato a la vacuna BNT162b2 en el estudio Fase 2/3, a un nivel de dosis de 30 μg en un régimen de 2 dosis.
Dicho candidato de vacuna, que recientemente recibió la designación “Fast Track” de la FDA, codifica una glicoproteína de longitud completa (Proteína S) de SARS-CoV-2, convirtiéndola en el objetivo de los anticuerpos neutralizantes del virus.
“Nuestra selección del candidato a la vacuna BNT162b2 y su avance a un estudio de Fase 2/3 son la culminación de un programa de I+D amplio, colaborativo y sin precedentes en el que participaron Pfizer, BioNTech, investigadores clínicos y participantes del estudio, con el enfoque singular de desarrollar una vacuna ARN contra el covid-19 segura y eficaz”, dijo Kathrin U. Jansen, Ph.D., Vicepresidenta Senior y Jefa de Investigación y Desarrollo de Vacunas en Pfizer.
“El protocolo de estudio Fase 2/3 sigue todas las directrices de la Administración de Alimentos y Medicamentos de los Estados Unidos, respecto al diseño de ensayos clínicos para estudios de vacunas Covid-19”, enfatizó.
“El inicio del ensayo de Fase 2/3 es un gran paso para nuestro progreso hacia el suministro de una vacuna potencial que ayude a combatir la pandemia COVID-19 en curso, y esperamos generar datos adicionales a medida que el programa avance”, añadió.
“Hoy, estamos comenzando nuestro estudio global en etapas tardías de la enfermedad, que incluirá hasta 30.000 participantes. Seleccionamos la BNT162b2 como nuestra candidata principal para esta prueba de Fase 2/3 tras una diligente evaluación de la totalidad de los datos generados hasta el momento”, puntualizó.

“Esta decisión refleja nuestro objetivo principal de llevar una vacuna bien tolerada y altamente eficaz al mercado lo más rápido posible, mientras continuamos evaluando a nuestras otras vacunas candidatas como parte de una cartera diferenciada de vacunas para covid-19”, aseguró Ugur Sahin, CEO y cofundador de BioNTech.
“Se han dado muchos pasos hacia este importante hito y nos gustaría dar las gracias a todos los involucrados por su extraordinario compromiso”, complementó.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...