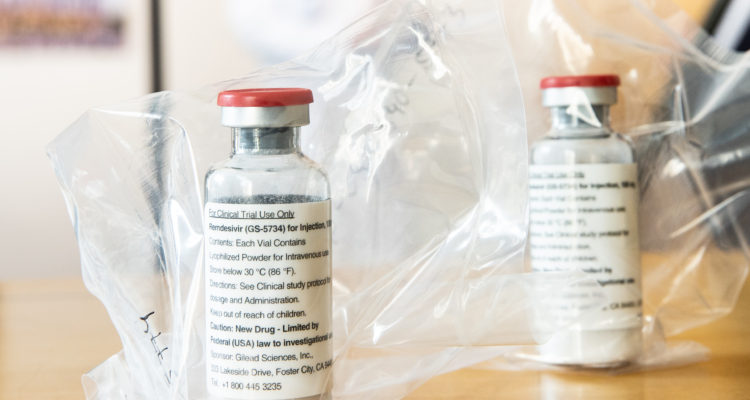
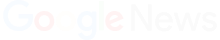Diversos laboratorios e instituciones alrededor de todo el mundo se encuentran trabajando arduamente con el objetivo de desarrollar una vacuna para el Covid-19.
Y es que la pandemia provocada por el SARS-CoV-2 ya ha dejado un saldo de más de 521 mil fallecidos a nivel global. En nuestro país, en tanto, la cifra oficial de muertos alcanza los 6.051.
Es bajo este contexto que han surgido dos nombres que han levantado algo de esperanza mientras la ansiada vacuna aún no llega: nos referimos al remdesivir e ivermectina.
¿En qué consisten estos fármacos? ¿Qué efectos se han detectado en contra del coronavirus? ¿Son realmente una solución viable para la pandemia?
El remdesivir es un antiviral fabricado por el laboratorio estadounidense Gilead Sciences cuyo uso de emergencia en el contexto de la actual pandemia fue aprobado en Estados Unidos luego de que un ensayo clínico mostrara que acorta el tiempo de recuperación en algunos pacientes con coronavirus.
Sin embargo, es importante precisar que pese a las expectativas que ha generado el remdesivir, aún no cuenta con la evidencia suficiente que sustente su uso en pacientes con Covid-19. En conversación con BioBioChile, Jaime de Calisto, director docente de la Escuela de Biotecnología de la U. Mayor, explicó en mayo pasado que “es una droga que fue creada con el objetivo de tratar patologías como el ébola y otras infecciones virales de distinta índole”.
“Los primeros registros en publicaciones que uno puede encontrar son bastante recientes, ya que recién en 2016 se publica el primer estudio que muestra la efectividad de esta droga para combatir las infecciones virales asociadas al ébola”, sostuvo.
“Básicamente es un análogo a una molécula que naturalmente nosotros tenemos en todas nuestras células, la cual el virus incorpora y detiene la maquinaria de reproducción del virus, por lo tanto es un compuesto con propiedades o actividad antiviral directa”, agregó.
En ese sentido, el fármaco se ha estado testeando en Estados Unidos con pacientes en estado grave, aunque bajo una autorización en estado de emergencia -producto de la situación- de la agencia reguladora de medicamentos de Estados Unidos (FDA), debido a que aún no se determna con precisión su seguridad y eficacia.
“Hace pocos días (en mayo) se amplió ese grupo a los que estaban en estado moderado de la enfermedad, ya que antes era sólo con quienes estaban en estado severo, porque no existe otra opción de tratamiento. En algunos casos se puede llamar uso compasivo de esta droga: son personas casi terminales que no tienen ningún otro tipo de medicamento que les pueda aliviar o curar esta enfermedad. Por lo tanto, es una autorización bastante restringida de emergencia”, aseveró.
En la misma línea, este viernes la Comisión Europea autorizó provisionalmente el uso de remdesivir para el tratamiento de pacientes con coronavirus en la Unión Europea (UE), después del visto bueno de la Agencia Europea de Medicamentos (EMA).
El ejecutivo comunitario concedió “una autorización de comercialización condicional para el medicamento remdesivir, convirtiéndolo en el primer remedio autorizado a nivel de la UE para el tratamiento del Covid-19“, anunció en un comunicado.
La autorización de comercialización condicional se reserva en la UE a aquellos fármacos, cuyos beneficios se estiman mayores a sus riesgos, pese a no contar aún con datos completos. Su duración es de un año renovable.
Por su parte, la ivermectina es un medicamento antiparasitario que, de acuerdo al Instituto de Salud Global de Barcelona, se usa contra la ceguera de los ríos, la filariasis linfática y otras enfermedades tropicales desatendidas.
“También tiene algún efecto antiviral contra los virus de ARN de una sola cadena como el dengue y la fiebre amarilla”, agrega el citado portal.
Tal como recoge la agencia de noticias Agence France-Presse, una publicación en redes sociales que en las últimas semanas se hizo viral afirmaba que “mata el coronavirus en 48 horas”.
“Si bien un estudio de laboratorio demostró que inhibe el virus causante de Covid-19 in vitro, es decir, en experimento fuera de un organismo vivo, su efectividad aún no se ha probado clínicamente en personas”, aclaró la agencia.
En efecto, el doctor Sebastián Ugarte, jefe de la unidad de pacientes críticos de la Clínica Indisa, explicó en el 24 Horas detalles de la investigación que lidera sobre el medicamento.
“Hasta el día de hoy en análisis interinos vamos en 82 paciente que hemos ido analizando interinamente y a las 48 horas chequeamos con una PCR para ver que resulta, y lo que hemos descubierto es que en el 94% la PCR se ha vuelto negativa”, comentó el especialista.
Eso sí, el doctor Ugarte llamó a la cautela, aclarando que “todavía no podemos decir nada porque tenemos un número mayor de pacientes que reunir”.
“Sin duda el estudio de la Universidad de Xian plantea que sería pertinente realizar un estudio en la atención primaria y entregar el tratamiento antes de que se hospitalice y ver si realmente logra una mejoría y disminuyen las hospitalizaciones y en definitiva las muertes por la enfermedad”, concluyó.
Cabe destacar que en mayo pasado, la Sociedad Chilena de Infectología (Sochinf) publicó un comunicado en sus redes sociales en el que recordó que “todo fármaco, para ser considerado e incorporado como terapia en determinada patología requiere de un gran número de estudios clínicos con tamaños muestrales adecuados de distintas poblaciones de seres humanos, y de diseños de investigación específicos que permitan evaluar su real impacto”.
En cuanto a la ivermectina, la entidad recalcó que es “un fármaco antiparasitario conocido, no exento de riesgos en su administración, y con escasos estudios in vitro o teóricos publicados respecto a acción frente a SARS-CoV-2, a la fecha sin demostración de utilidad en humanos contra el virus que produce el COVID-19. Existen algunos estudios en desarrollo, sin que se hayan comunicado sus resultados aún”.
Finalmente, la Sochinf hizo un llamado a la población para tomar la información de cualquier tipo de terapia con extrema cautela, y a no automedicarse.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...