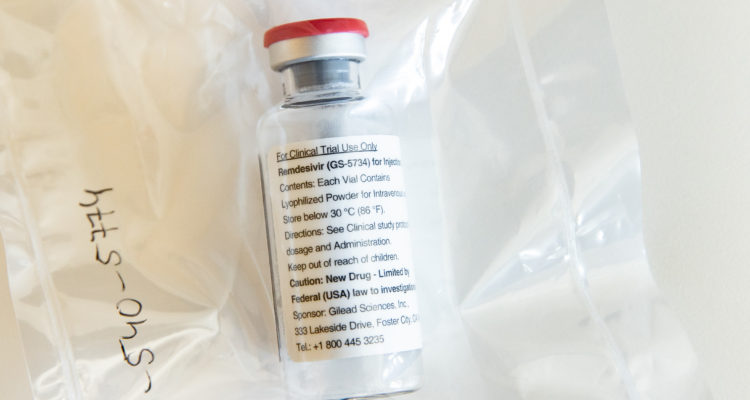
La agencia reguladora de medicamentos de Estados Unidos (FDA) autorizó el uso de emergencia del fármaco experimental remdesivir en pacientes graves con Covid-19, según anunció el viernes pasado el presidente Donald Trump.
El uso de este antiviral fabricado por el laboratorio estadounidense Gilead Sciences fue aprobado luego de que un importante ensayo clínico mostrara que acorta el tiempo de recuperación en algunos pacientes con el nuevo coronavirus. Fue la primera vez que un medicamento demostró un beneficio contra la enfermedad.
El remdesivir, que se administra mediante una inyección, ya estaba disponible para algunos pacientes que se inscribieron en ensayos clínicos, mientras que otros lo recibieron al margen de esas pruebas en la llamada modalidad de “uso compasivo”.
La aprobación permite que se use tanto en adultos como en niños hospitalizados que estén graves.
Sin embargo, es importante precisar que pese a las expectativas que ha generado el remdesivir, aún no cuenta con la evidencia suficiente que sustente su uso en pacientes con Covid-19. Es por esto que BioBioChile se contactó con Jaime de Calisto, director docente de la Escuela de Biotecnología de la U. Mayor, para que explique los detalles en torno a este fármaco.
“Es una droga que fue creada con el objetivo de tratar patologías como el ébola y otras infecciones virales de distinta índole. Los primeros registros en publicaciones que uno puede encontrar son bastante recientes, ya que recién en 2016 se publica el primer estudio que muestra la efectividad de esta droga para combatir las infecciones virales asociadas al ébola”, comenzó señalando.
“Básicamente es un análogo a una molécula que naturalmente nosotros tenemos en todas nuestras células, la cual el virus incorpora y detiene la maquinaria de reproducción del virus, por lo tanto es un compuesto con propiedades o actividad antiviral directa”, agregó.
“Cuando la droga o molécula entra en las células ya infectadas, el virus para poder reproducir su genoma, incorpora sin saberlo esta molécula y eso eventualmente detiene la maquinaria de reproducción del virus. Básicamente se generan copias del RNA que no son activas, que no le sirven al virus, por lo tanto detiene su reproducción una vez que ya ha infectado a la célula”, puntualizó.
“Entonces se está testeando para pacientes que ya están infectados, y primero se parte con pacientes en estado grave. Esta aprobación en EEUU para su uso está solamente limitado a pacientes Covid-19 positivos, y eso es importante destacarlo, no es que se haya dado una autorización ‘masiva’ para este compuesto, porque todavía no se determina con precisión su seguridad y eficacia”, continuó.
En ese sentido, explica el experto, lo que hizo la FDA fue hacer una autorización en estado de emergencia producto de la pandemia actual.
“Esto tiene un limitado uso preclínico porque todavía son estudios, en donde lo que se está haciendo es aumentar el número de pacientes que pueden entrar a recibir la droga”, sostuvo. “Básicamente las entidades que regulan la administración de esta droga experimental deciden arriesgarse en incluir a un grupo de pacientes más grandes”, añadió.
“Hace pocos días se amplió ese grupo a los que estaban en estado moderado de la enfermedad, ya que antes era sólo con quienes estaban en estado severo, porque no existe otra opción de tratamiento. En algunos casos se puede llamar uso compasivo de esta droga: son personas casi terminales que no tienen ningún otro tipo de medicamento que les pueda aliviar o curar esta enfermedad. Por lo tanto, es una autorización bastante restringida de emergencia”, aseveró.
¿Se pueden establecer plazos?
En cuanto a definir un plazo para el que este fármaco podría ser aprobado para su uso masivo en pacientes con Covid-19, el director docente de la Escuela de Biotecnología de la U. Mayor indicó que el problema radica en la duración de los estudios, “ya que hay que pensar que se está jugando con la vida y la muerte”.
“Recordemos lo que pasó en Brasil hace algunas semanas atrás. Con la droga antimalaria se murieron 11 personas por lo que se detuvieron inmediatamente todos los estudios preclínicos que se estaban realizando”, comentó.
“La droga en sí tiene eficacia probada como antiviral en modelos celulares, en modelos animales y de hecho en humanos también. En otras patologías como el ébola o SARS, los pacientes mostraron mejorías. Pero en este caso estamos hablando de un virus y una patología nueva, por lo que nos estamos enfrentando a algo desconocido”, expresó.
“En términos temporales, que es obviamente lo que le importa al público, es complicado definir una fecha, porque primero tiene que existir un grupo de pacientes que tenga la enfermedad, que muestren una mejoría, que el análisis de esos datos le de una significancia estadística relevante”, ahondó.
“Hasta el momento existen -por lo menos de mi conocimiento- dos estudios, uno en China que mostró una mejoría moderada o modesta, y otro en EEUU con un número de pacientes más grande en el que la mejoría fue alrededor de un 30%, y eso fueron resultados más esperanzadores, dando el puntapié inicial para ampliar este uso en emergencia de la molécula”, destacó.
“Por lo tanto, si los estudios concluyen con resultados positivos y se demuestra que el compuesto no es más dañino que la enfermedad y el efecto es claro, existiendo una mejoría, el paso siguiente es que la compañía sea capaz de producir cantidades suficientes para abastecer al mundo, porque no estamos hablando de mil o dos mil pacientes, sino que estamos hablando de millones”, destacó.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...