Más de 50 científicos de siete países firman uno de los mayores avances en oncología desde hace más de un siglo. Han descubierto que los tumores primarios envían sondas mensajeras capaces de convertir a otros órganos en lugares acogedores para las células cancerosas. Además, estos destacamentos del tumor llevan etiquetas que definen cuál será su próxima víctima. El hallazgo es clave para interceptar el proceso metastásico.
Entender por qué un tumor genera metástasis en unos órganos y no en otros es una de las mayores aspiraciones de la oncología, y también una de las más antiguas. Hace 126 años el médico británico Stephen Paget formuló su teoría de semilla y sustrato, que defiende que la metástasis necesita células tumorales —semillas— que se dispersan, pero además un ambiente acogedor —un sustrato fértil— en el órgano de destino. Sin embargo, desde entonces “el progreso para decodificar los mecanismos que dirigen la metástasis a órganos específicos ha sido insuficiente”, escriben en Nature los autores del trabajo.
En los últimos años Héctor Peinado, jefe del Grupo de Microambiente y Metástasis del CNIO (Centro Nacional de Investigaciones Oncológicas), ha desarrollado junto con David Lyden, del Weill Cornell Medical College, y Jaqueline Bromberg, del Memorial Sloan Kettering Cancer Center, una teoría que se apoya en la teoría de semilla y sustrato de Paget, y la amplía.
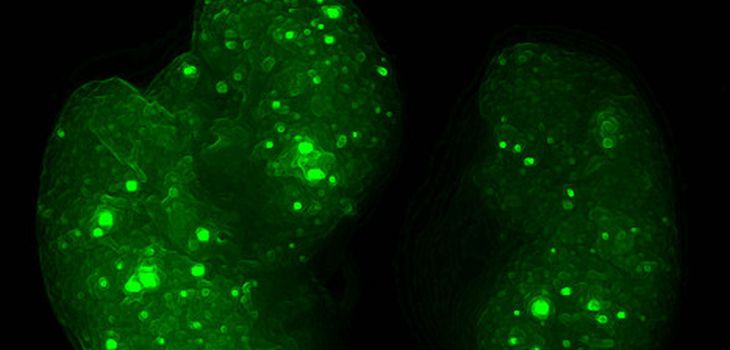
Ayuko Hoshino y Bruno Costa-Silva, primeros coautores en esta publicación, han recopilado, junto con Peinado y Lyden, indicios de que los tumores emiten millones de vesículas cargadas con una representación de sus proteínas y su contenido genético, llamadas exosomas, a modo de naves mensajeras o destacamentos, y son estos exosomas los que se ocupan de que los órganos de destino estén preparados para acoger las células tumorales. En concreto, los exosomas desencadenan en el órgano de destino la respuesta molecular necesaria —inflamación y vascularización— para acoger las células tumorales, de forma que cuando estas lleguen puedan proliferar.
“Este mecanismo que postulamos era hasta ahora desconocido en la formación de nichos metastásicos”, explica Peinado. El trabajo actual corrobora su existencia, porque confirma que los exosomas tienen un papel crucial en la formación de las metástasis.
Pero los investigadores quisieron ir más allá. Sabían que de los millones de exosomas que parten del tumor solo algunos anidan, y además no lo hacen en un órgano al azar, sino en algunos más que en otros. ¿Por qué? ¿Podía ser que los exosomas, los destacamentos del tumor, llevaran etiquetas moleculares que de alguna manera los dirigieran a órganos específicos?

El investigador Héctor Peinado en su laboratorio. /CNIO
Etiquetas de destino
Para investigar la hipótesis los autores escogieron varias líneas celulares procedentes de una decena de tumores distintos, y de los que se sabe que algunos metastatizan a órganos concretos —pulmón, hígado, cerebro o hueso—. Analizaron las proteínas de sus exosomas —casi un millar de proteínas— en busca de las que podrían cumplir esa función de código postal.
Pusieron el foco en una familia de proteínas llamadas integrinas, porque están en la membrana de los exosomas, donde teóricamente debería estar una etiqueta de destino. Y fue una buena estrategia. De entre un millar de proteínas encontraron que, efectivamente, hay combinaciones específicas de integrinas asociadas con metástasis en pulmón, y con metástasis en hígado.
Como señala Peinado, “hemos determinado que existe una combinación de integrinas en los exosomas tumorales que predispone la formación de nichos metastásicos en órganos concretos, específicamente en pulmón e hígado.
“Nuestros resultados proponen que existe una especie de código postal en la superficie de los exosomas que les hace llegar a órganos concretos y acumularse donde se va a producir la metástasis”, prosigue el investigador.
Si se engaña a un tumor cambiándole el código de destino, colonizará el órgano que le indiquemos. Esto se ha probado con células tumorales que normalmente irían al hueso, y que tras la intervención de los investigadores se dirigen al pulmón. Estos datos apoyan que el sustrato es igual de importante que la semilla en el proceso metastásico.
Otra evidencia de la importancia de las integrinas en el anidamiento de la metástasis es que, tal y como se demuestra en el trabajo, si se bloquean integrinas específicas en tumores que metastatizan a órganos concretos —por ejemplo cáncer de mama a pulmón y cáncer de páncreas a hígado— se reduce la metástasis en esos órganos.
Preparando el terreno
Además, los investigadores han descubierto las señales moleculares que median la reacción del tejido de destino cuando llegan los exosomas. En concreto, estas señales implican el aumento de genes de la familia S100, conocidos por promover señales inflamatorias —la inflamación es un proceso que se asocia con el cáncer—.
Estos resultados suponen la identificación de posibles nuevas dianas farmacológicas, dice Peinado: “Hemos definido un nuevo mecanismo de metástasis a órganos concretos que implica a integrinas y proteínas S100, que podrían ser usadas como nuevas dianas antimetastásicas”.
El trabajo se ha hecho con líneas celulares tumorales humanas y de ratón; con modelos preclínicos murinos; y con plasma de pacientes con cáncer.
Esto último ha servido para estudiar, de forma preliminar, el poder predictivo de las integrinas identificadas; es decir, si solo analizando las integrinas de los exosomas se puede saber en qué organos podría haber metástasis.
“Nuestro trabajo sugiere que tener ciertas integrinas elevadas en plasma en pacientes con cáncer de mama y páncreas parece predecir el órgano donde se va a producir la metástasis”, dice Peinado. “Pero estos datos han de validarse en cohortes mayores, y desarrollar test predictivos”.
Estos resultados generan una lista de tareas inmediatas para los investigadores, desde ampliar los estudios con pacientes para tratar de afinar el poder predictivo de las integrinas —con tecnologías específicas de análisis que aún deben ser desarrolladas—, hasta identificar otros códigos postales que determinen la metástasis a cerebro o hueso.
No menos importante es la búsqueda de nuevos fármacos: “En el futuro nos planteamos el desarrollo de moléculas para bloquear las combinaciones de integrinas específicamente en el tejido tumoral”, afirma Peinado.
Este trabajo es el resultado de una colaboración internacional, multidisciplinar y multiinstitucional, que implica la obtención de múltiples modelos celulares, preclínicos y muestras humanas. La búsqueda de estos modelos se ha llevado a cabo durante los tres últimos años y en ella han participado muchos equipos, lo que se refleja en el alto número de firmantes.
El hallazgo ayudará a definir el mejor tratamiento para cada paciente y a vigilar la aparición de metástasis. Más a largo plazo, será esencial para interceptar los primeros estadíos de formación de las metástasis.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...