Carlos, enfermero de un Centro de Salud Familiar (Cesfam) del sector occidente de la región Metropolitana, estaba atendiendo a una adolescente como cualquier otro día. Era una joven que necesitaba una píldora del día después.
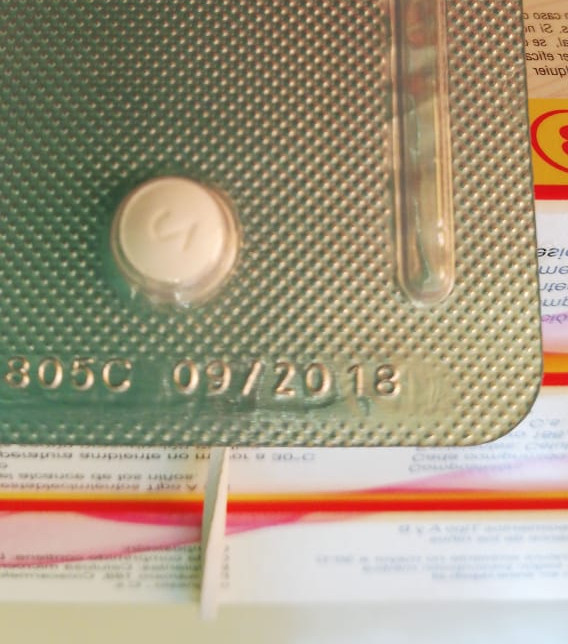
Tras recibir la receta del médico a cargo, Carlos -que solicitó resguardo de su identidad- fue a buscar el medicamento y advirtió una situación que no había visto antes: el fármaco, la píldora del día después, tenía dos fechas de vencimiento, una en la caja y otra en el envase de plástico (blister).

La alarma fue inmediata. Nadie les había avisado de algo como esto. Tampoco sabían qué argumentos podían existir detrás de una decisión de este tipo y, como consecuencia, una serie de dudas comenzaron a surgir en relación a la efectividad y/o toxicidad del medicamento.
Por lo mismo, resuelta la atención de la joven, el funcionario de la salud comenzó una búsqueda personal para entender qué significaban estas dos fechas de expiración contradictorias.
Sabiendo cuál era el medicamento, al poco tiempo encontró una resolución del Instituto de Salud Pública (ISP) que explicaba casi todo.
Se trataba del medicamento Cerciora T del laboratorio Exeltis, píldora del día después a la cual se le modificó su fecha de expiración en más de 90 mil envases. Lo anterior, tras una solicitud al ISP por parte de la empresa.
En el detalle, la fecha de vencimiento pasaba de 24 meses, desde su fecha de elaboración, a 36. Un año más.
Para lograr la aprobación de dicha solicitud, la empresa presentó una serie de estudios donde, según indicó el ISP, se comprobaba que la extensión era posible ya que se mantenía la estabilidad (molecular) de los medicamentos.
Sin embargo, los funcionarios de al menos 2 Cesfam en la región Metropolitana denuncian que esto no fue informado a los trabajadores y que tampoco conocen los estudios detrás de la decisión, por lo que cuando encontraron los fármacos con doble fecha de vencimiento (una en la caja y otra en el envase/blister) se preocuparon ya que estas eran distintas.
Un error gravísimo
Frente a todo esto, varios médicos de dichos centros asistenciales de salud primaria dejaron de recetar el medicamento ante la desconfianza sobre su efectividad.
Algo que fue respaldado por el médico cirujano de la PUC, Enrique Paris, actual decano de la Facultad de Ciencias de la Universidad Mayor, fundador del Centro de Información Toxicológica de la UC y expresidente del Colegio Médico, quien conversó con BioBioChile.
Paris calificó los hechos como “muy graves” por varias razones: ya sea por la presencia de dos fechas de vencimiento en el medicamento, por la falta de comunicación a los funcionarios de la decisión o por la no transparencia de los estudios que fundamentan la extensión de la fecha.
El profesional crítico la decisión ya que genera desconfianza en los médicos tratantes y en los usuarios, pero aclaró en el caso de este medicamento no existen riesgos de toxicidad; pero sí de ineficacia.
Además, aclaró que las solicitudes de extensión pueden ocurrir, que no son frecuentes, pero que es necesario hacer visibles los estudios detrás de esta. En ese sentido, calificó como un “error gravísimo” que no se haya cumplido con estas condiciones.
Estudios invisibles
En la mencionada resolución del ISP explican las razones por las cuales se permitió el cambio.
En ella se argumenta que el laboratorio confirmó a través de estudios propios que los medicamentos sí podían tener fecha de vencimiento extendida, lo cual fue validado por el ISP tal como indica la resolución.
“La empresa demostró que el periodo de eficacia podía ser extendido a 36 meses para lotes cuyo PE (periodo de expiración) había sido sido determinado en 24. Respecto de este punto y en consideración a que ambos productos cuentan con informe de validación de la manufactura, que no hubo ni cambios de principios de fabricación ni de fórmula entre aquellos lotes que demostraron un PE 36 meses, no se encuentra impedimento técnico en poder acoger la solicitud de otorgar por única vez un acondicionamiento con el PE de 36 meses”, señalan.
Revisa la resolución a continuación:
BioBioChile se contactó con el ISP y con el laboratorio Exeltis para conocer los estudios mencionados en la resolución y hacerlos públicos, pero no fue posible. La autoridad sanitaria argumentó que sólo podían pedirse los estudios a través de Transparencia, lo que se realizó, pero hasta el momento de publicación no se ha respondido la solicitud.
En tanto, tras consultar al laboratorio, se indicó que la empresa estaba de vacaciones y que no había personal disponible para gestionar la solicitud.
Finalmente, desde el ISP insistieron en que la decisión de extensión está fundamentada y que no debe existir desconfianza de la nueva fecha de vencimiento.
“Es importante enfatizar que la extensión de la vigencia de la eficacia de un producto farmacéutico debe estar sustentada en la información disponible sobre su estabilidad, que ésta es una decisión que le compete a la autoridad sanitaria, y que, una vez que se ha adoptado esta decisión, el ciudadano puede tener la certeza de que la calidad del producto sigue siendo la óptima y éste cumple con todas las características esperadas, durante todo el nuevo periodo de vigencia asignado“, explicaron.