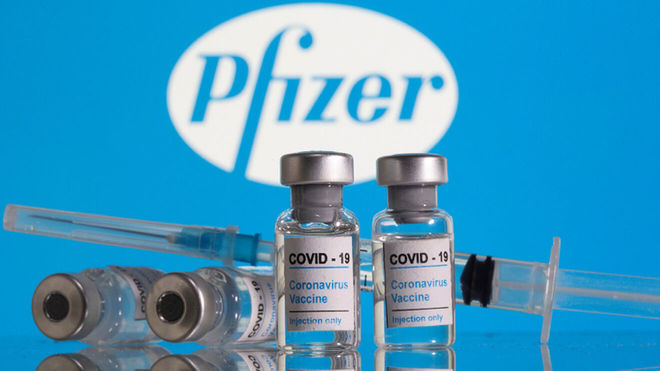
La Agencia de Medicamentos de Estados Unidos (FDA) aprobó en su totalidad el uso de la vacuna Pfizer de BioNTech, lo que significa además que dejará de ser considerada una vacuna de “emergencia”.
En un principio, las vacunas obtuvieron su calidad de “emergencia” debido al contexto grave de la pandemia a nivel mundial, siendo Pfizer la primera en obtener esa autorización, siendo aplicada en Reino Unido.
“Una Autorización de Uso de Emergencia (EUA, por sus siglas en inglés), es un mecanismo para facilitar la disponibilidad y el uso de contramedidas médicas, incluidas las vacunas, durante las emergencias de salud pública, como la actual pandemia causada por el covid-19”, según información que recoge Infobae.
Ahora, que la FDA haya aprobado en su totalidad a esta vacuna, significa que Pfizer cumplió con todos los requisitos necesarios, incluyendo la reducción de efectos secundarios en pacientes inoculados.
“Si bien millones de personas ya han recibido vacunas contra el COVID-19 de manera segura, reconocemos que para algunos, la aprobación de una vacuna por parte de la FDA puede infundir ahora una confianza adicional para vacunarse”, dijo Janet Woodcock, comisionada de la FDA a la Agencia AFP.
Para otorgar esta aprobación, diversos científicos debieron analizar cada estudio realizado a esta vacuna, para así asegurarse de que no existiera ninguna discrepancia del nuevo status que tendría esta inoculación, explica Paul Offit, miembro de la FDA al medio antes citado.
Al ser la primera vacuna en aprobarse en su totalidad en Estados Unidos, permitirá su comercialización, además de poder ser requerida por los empleadores o diversas instituciones como requisito.
De acuerdo a información que recoge Infobae, “la aprobación permitirá la prescripción de vacunas para uso “no indicado en la etiqueta”, pudiendo ser utilizados para fines distintos de aquellos para los que fueron aprobados inicialmente.
“La prescripción no autorizada es legal, pero solo cuando los medicamentos han recibido la aprobación total de la FDA. Una vez que esto suceda con las vacunas COVID-19, los médicos podrán estudiar más a fondo su uso para tratar una variedad de otras enfermedades”, sostiene el medio antes citado.
La vacuna sigue estando disponible bajo autorización de uso de emergencia para los niños de 12 a 15 años, pero como ahora ha sido plenamente aprobada, los médicos pueden prescribirla a los niños menores de 12 años si creen que será beneficiosa, agrega AFP.
Por su parte, Albert Bourla, presidente y director ejecutivo de Pfizer, señaló que “espero que esta aprobación ayude a aumentar la confianza en nuestra vacuna, ya que la vacunación sigue siendo la mejor herramienta que tenemos para ayudar a proteger vidas y lograr la inmunidad colectiva”, según consigna CNN en Español.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...